DIFERENCIA ENTRE CALOR Y TEMPERATURA
DEFINICIÓN DECALOR
El calor es aquello que siente un ser vivo ante una temperatura elevada. La física entiende el calor como la energía que se traspasa de un sistema a otro o de un cuerpo a otro, una transferencia vinculada al movimiento de moléculas, átomos y otras partículas.
En este sentido, el calor puede generarse a partir de una reacción química (como la combustión), una reacción nuclear (como aquellas que se desarrollan dentro del Sol) o una disipación (ya sea mecánica, fricción, o electromagnética, microondas).
https://definicion.de/calor/. (2013). DEFINICION DE CALOR. 13/O2/19, de RAE Sitio web: https://definicion.de/calor/
CALOR
Es la forma de energía que se transfiere espontáneamente entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa simplemente transferencia de energía.
HISTORIA DEL CALOR
Hasta el siglo XIX se explicaba el efecto del ambiente en la variación de la temperatura de un cuerpo por medio de un fluido invisible llamado calórico. Este se producía cuando algo se quemaba y, además, que podía pasar de un cuerpo a otro. La teoría del calórico afirmaba que una sustancia con mayor temperatura que otra, necesariamente, poseía mayor cantidad de calórico.
Benjamin Thompson y James Prescott Joule establecieron que el trabajo podía convertirse en calor o en un incremento de la energía térmica determinando que, simplemente, era otra forma de la energía.
CALOR ESPECIFICO
Es la energía necesaria para elevar 1 °C la temperatura de un gramo de materia.
El calor específico es un parámetro que depende del material y relaciona el calor que se proporciona a una masa determinada de una sustancia con el incremento de temperatura:
CALOR ESPECIFICO MOLAR
El calor específico de una sustancia está relacionado su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares.
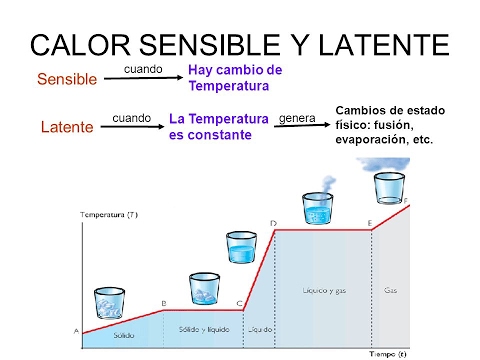
CALOR LATENTE
Es cuando un cuerpo sólido puede estar en equilibrio térmico con un líquido o un gas a cualquier temperatura, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, ya que se trata de sustancias diferentes.
CALOR CALORÍFICA
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por  , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
Dado que:
De igual forma se puede definir la capacidad calórica molar como:
CAMBIOS DE FASE DEL CALOR
- De estado sólido a líquido, llamado fusión,
- De estado líquido a sólido, llamado solidificación,
- De estado líquido a gaseoso, llamado evaporación o vaporización,
- De estado gaseoso a líquido, llamado condensación,
- De estado sólido a gaseoso, llamado sublimación progresiva,
- De estado gaseoso a sólido, llamado sublimación regresiva o deposición,
- De estado gaseoso a plasma, llamado ionización.
- De estado plasma a gaseoso, llamado Desionización
TRANSMISIÓN DE CALOR
Conducción térmica: es el proceso que se produce por contacto térmico entre dos ó más cuerpos, debido al contacto directo entre las partículas individuales de los cuerpos que están a diferentes temperaturas, lo que produce que las partículas lleguen al equilibrio térmico.
Ej: cuchara metálica en la taza de té.
Convección térmica: sólo se produce en fluidos (líquidos o gases), ya que implica movimiento de volúmenes de fluido de regiones que están a una temperatura, a regiones que están a otra temperatura ejemplo: los calefactores dentro de la casa.
Radiación térmica: es el proceso por el cual se transmite a través de ondas electromagnéticas. Implica doble transformación de la energía para llegar al cuerpo al que se va a propagar: primero de energía térmica a radiante y luego viceversa.
Ej.: La energía solar.
Conductividad térmica de un cuerpo está dada por:
donde:
MEDIDA EXPERIMENTAL DEL CALOR
Para determinar, de manera directa, el calor que se pone de manifiesto en un proceso de laboratorio, se suele emplear un calorímetro. En esencia, se trata de un recipiente que contiene el líquido en el que se va a estudiar la variación de energía por transferencia de calor y cuyas paredes y tapa (supuestamente adiabáticas) deben aislarlo, al máximo, del exterior.
Un termo de paredes dobles de vidrio, cuyas superficies han sido previamente metalizadas por deposición y que presenta un espacio vacío entre ellas es, en principio, un calorímetro aceptable para una medida aproximada de la transferencia de calor que se manifiesta en una transformación tan sencilla como esta. En la tapa aislante suele haber un par de orificios para introducir un termómetro con el que se evaluaría el incremento (o decremento) de la temperatura interior del líquido, y un agitador para tratar de alcanzar el equilibrio térmico en su interior lo más rápido posible, usando un sencillo mecanismo de convección forzada.
No sólo el líquido contenido en el calorímetro absorbe calor, también lo absorben las paredes del calorímetro. Lo mismo sucede cuando pierde calor. Esta intervención del calorímetro en el proceso se representa por su equivalente en agua. La presencia de esas paredes, no ideales,equivale a añadir al líquido que contiene, los gramos de agua que asignamos a la influencia del calorímetro y que llamamos "equivalente en agua". El "equivalente en agua" viene a ser "la cantidad de agua que absorbe o desprende el mismo calor que el calorímetro".
TERMODINÁMICA Y TRANSFERENCIA DE CALOR
La termodinámica se interesa en la cantidad de transferencia de calor a medida que un sistema pasa por un proceso, sin indicar cuánto tiempo transcurrirá.
ÁREAS DE APLICACIÓN DE LA TRANSFERENCIA DE
CALOR
Es común encontrar la transmisión de calor en los sistemas de ingeniería y otros aspectos de la vida; y no es necesario ir muy lejos para ver algunas de sus áreas de aplicación. Es más, uno de los ejemplos más sencillos lo encontramos dentro del cuerpo humano, éste permanece emitiendo calor en forma constante hacia sus alrededores y la comunidad humana está íntimamente influenciada por la velocidad de esta emisión de calor.
TRANSFERENCIA DEL CALOR EN
LA INGENIERÍA
Los problemas de capacidad nominal se ocupan de la determinación de la velocidad de transferencia de calor para un sistema existente con una diferencia específica de temperatura.
SENSACIÓN DEL CALOR EN EL SER
HUMANO
Generalmente en la mayoría de los países, se habla ya de calor cuando la temperatura supera los 26 ºC en cualquier hora del día, aunque varía mucho según la estación del año en que se encuentre una persona. Por ejemplo, 20 ºC en verano es considerado una temperatura fresca, mientras que en invierno, esta temperatura es considerada templada o cálida.
El fenómeno "ola de calor" se da cuando las temperaturas diurnas superan los 32 ºC y las nocturnas (o al amanecer) no bajan de los 23 ºC por 3 días y es común en casi todo tipo de climas en época veraniega, a excepción de los países cerca de los polos, con clima templado y polar, cuando es muy infrecuente o casi nulo, y se hace más frecuente cuando los países están más cerca de los trópicos (países con climas tropical y subtropical).
CARACTERÍSTICAS DEL CALOR
- El calor es una forma de energía asociada al movimiento de los átomos, moléculas y otras partículas que forman la materia
- El calor puede ser generado por reacciones químicas (como en la combustión.
- Su concepto está ligado al Principio Cero de la Termodinámica, según el cual dos cuerpos en contacto intercambian energía hasta que su temperatura se equilibre
- El calor puede ser transferido entre objetos por diferentes mecanismos, entre los que cabe reseñar la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos los mecanismos anteriores se encuentran presentes en mayor o menor grado.
- El calor que puede intercambiar un cuerpo con su entorno depende del tipo de transformación que se efectúe sobre ese cuerpo y por tanto depende del camino. Los cuerpos no tienen calor, sino energía interna.
- El calor es la transferencia de parte de dicha energía interna (energía térmica) de un sistema a otro, con la condición de que estén a diferente temperatura.
CLASIFICACIÓN DE CALOR
El calor radiante es como el calor del sol y es transferido por olas de calor infrarrojo.
Calor por convección, la mayor parte de la energía que recibe el calefactor, es transferida al aire por convección.
¿COMO SE MIDE EL CALOR?
Se mide el calor con los termómetros son útiles porque, en general, deseamos medir el calor de acuerdo a nuestra concepción del mismo. Además, trabajan en diferentes escalas. Las escalas más conocidas por todos nosotros son las siguientes:
- Grado Celsius (ºC)
- Grado Fahrenheit (ºF)
- Grado Réaumur (ºRé)
¿DONDE ESTA EL CALOR EXTRA?
Cuando se habla del calentamiento global se menciona a los “gases invernadero” como factor fundamental para el cambio climático. Una parte importante de esos gases son generados en abundancia por el hombre y tienen la propiedad de retener una parte de la radiación que nuestro planeta recibe del Sol.
¿QUIEN DESCUBRIÓ EL CALOR?
Joseph Black
(Burdeos; 16 de abril de 1728 - Edimburgo; 10 de noviembre de 1799) fue un médico, físico y químico escocés.
Sus investigaciones más importantes se centraron en el campo de la termodinámica, donde estableció una clara distinción entre temperatura y calor, e introdujo conceptos como el calor específico y el calor latente de cambio de estado. Además se le debe el descubrimiento deldióxido de carbono.
CALOR LATENTE Y CALOR ESPECIFICO
En 1761 Black se dio cuenta de que la aplicación de calor al hielo, no lo convertía a éste inmediatamente en líquido, sino que el hielo absorbía cierta cantidad de calor sin aumentar su temperatura. También observó que la aplicación de calor al agua hirviendo, no daba como resultado la inmediata evaporación. De estos trabajos dedujo que el calor aplicado, tanto al hielo como al agua hirviente, tenía que tener una cierta combinación con las partículas de hielo y de agua y convertirse en "calor latente".
IMPORTANCIA DEL CALOR
Dependemos totalmente de este fenómeno y de su precisión; sin el calor no podría existir la vida tanto animal como vegetal. Este es uno de los tantos fenómenos que tiene un equilibrio tanto en el interior de los cuerpos como con el exterior o el medio ambiente; este equilibrio de temperaturas no se puede perder y es por lo que los animales que viven en zonas muy frías tiene una piel muy gruesa y nosotros nos cubrimos con ropa abrigada en invierno para mantener esa temperatura.
https://sites.google.com.
- https://sites.google.com/site/ultrafisica/indice-de-contenido/calor-fisica. (2014). HISTORIA DEL CALOR. 11/02/19, de BLOG TEMATICO Sitio web: https://sites.google.com/site/ultrafisica/indice-de-contenido/calor-fisica
CALOR ESPECIFICO Y LATENTE.
El calor específico, el calor sensible y el calor latente son magnitudes físicas:
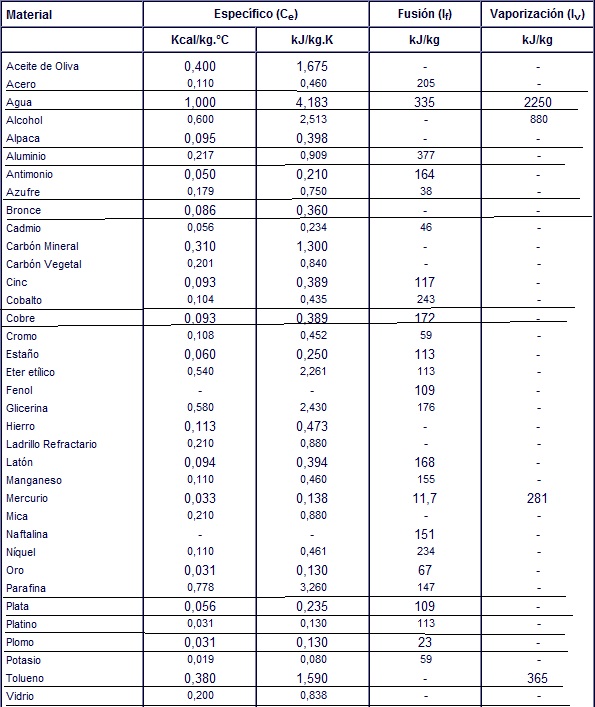
El calor específico de una sustancia es la cantidad de calor que hay que suministrar a una unidad de masa de esa sustancia para elevar su temperatura en una unidad. Esa cantidad varía tanto dependiendo de la temperatura en que se encuentra la sustancia antes de aplicarle el calor. Por ejemplo, es necesaria una caloría para aumentar en un grado el agua a temperatura ambiente, pero es necesaria sólo 0,5 caloría para aumentar en un grado la temperatura del hielo a -5 grados. El calor específico también depende de la presión atmosférica. La misma sustancia a una presión atmosférica menor tiene un menor calor específico. Los ejemplos que aparecen a continuación son válidos para una temperatura de 25 grados y a una presión de 1 atmósfera.
El calor sensible es la cantidad de calor que puede recibir un cuerpo sin que se afecte su estructura molecular. Si no cambia la estructura molecular no cambia el estado (sólido, líquido, gaseoso). Dado que no cambia la estructura molecular, se observa un cambio de temperatura, por eso se denomina calor sensible.
El calor latente es la energía (calor) necesario para que una sustancia cambie de fase (estado). Si el cambio es de sólido a líquido se denomina calor de fusión. Si el cambio es de líquido a gaseoso se denomina calor de vaporización. Cuando se le aplica calor a una sustancia que ha llegado a la temperatura en que cambia de estado, es imposible que aumente la temperatura, sino que simplemente cambia de estado. Por ejemplo, si se continúa aplicando calor al agua en ebullición, la misma no sobrepasará nunca los 100 °C. Dependiendo de la sustancia, el calor latente puede medirse habitualmente en calorías por gramo o en kilojoules por kilogramo (KJ).
Ejemplos de calor específico
 Agua (en estado líquido): 1 Caloría por gramo para aumentar 1 °C
Agua (en estado líquido): 1 Caloría por gramo para aumentar 1 °C Aluminio: 0.215 caloría por gramo
Aluminio: 0.215 caloría por gramo Berilio: 0.436 caloría por gramo
Berilio: 0.436 caloría por gramo Cadmio: 0.055 caloría por gramo
Cadmio: 0.055 caloría por gramo Cobre. 0.0924 caloría por gramo
Cobre. 0.0924 caloría por gramo Glicerina: 0.58 caloría por gramo
Glicerina: 0.58 caloría por gramo Oro: 0.0308 caloría por gramo
Oro: 0.0308 caloría por gramo Hierro: 0.107 caloría por gramo
Hierro: 0.107 caloría por gramo Plomo: 0.0305 caloría por gramo
Plomo: 0.0305 caloría por gramo Silicio: 0.168 caloría por gramo
Silicio: 0.168 caloría por gramo Plata: 0.056 caloría por gramo
Plata: 0.056 caloría por gramo Potasio: 0.019 caloría por gramo
Potasio: 0.019 caloría por gramo Tolueno: 0.380 caloría por gramo
Tolueno: 0.380 caloría por gramo Vidrio: 0.2 caloría por gramo
Vidrio: 0.2 caloría por gramo Mármol: 0.21 caloría por gramo
Mármol: 0.21 caloría por gramo Madera: 0.41 caloría por gramo
Madera: 0.41 caloría por gramo Alcohol etílico: 0.58 caloría por gramo
Alcohol etílico: 0.58 caloría por gramo Mercurio: 0.033 caloría por gramo
Mercurio: 0.033 caloría por gramo Aceite de oliva: 0.47 caloría por gramo
Aceite de oliva: 0.47 caloría por gramo Arena: 0.2 caloría por gramo
Arena: 0.2 caloría por gramo
Ejemplos de calor sensible
 Aplicar calor al agua que se encuentre entre 1 y 100 °C
Aplicar calor al agua que se encuentre entre 1 y 100 °C Aplicar calor a estaño que se encuentre a menos de 240 °C
Aplicar calor a estaño que se encuentre a menos de 240 °C Aplicar calor a plomo que se encuentre a menos de 340 °C
Aplicar calor a plomo que se encuentre a menos de 340 °C Aplicar calor a zinq que se encuentre a menos de 420 °C
Aplicar calor a zinq que se encuentre a menos de 420 °C Aplicar calor a aluminio que se encuentre a menos de 620 °C
Aplicar calor a aluminio que se encuentre a menos de 620 °C Aplicar calor a bronce que se encuentre a menos de 880 °C
Aplicar calor a bronce que se encuentre a menos de 880 °C Aplicar calor a níquel que se encuentre a menos de 1450 °C
Aplicar calor a níquel que se encuentre a menos de 1450 °C
Ejemplos de calor latente
Agua: calor latente de fusión: 80 calorías por gramo (son necesarias 80 calorías para que un gramo de hielo a 0 °C se convierta en agua), calor latente de vaporización: 540 calorías por gramo (son necesarias 540 calorías para que un gramo de agua a 100 °C se convierta en vapor).
Acero: calor latente de fusión: 50 calorías
Alumino: calor latente de fusión: 85 calorías / 322-394 KJ; calor latente de vaporización: 2300 KJ.
Azufre: calor latente de fusión: 38 KJ; calor latente de vaporización: 326 KJ.
Cobalto: calor latente de fusión: 243 KJ
Cobre: calor latente de fusión: 43 calorías; calor latente de vaporización: 2360 KJ.
Estaño: calor latente de fusión: 14 calorías / 113 KJ
Fenol: calor latente de fusión: 109 KJ
Hierro: calor latente de fusión: 293 KJ; calor latente de vaporización: 2360 KJ.
Magnesio: calor latente de fusión: 72 calorías
Mercurio: calor latente de fusión: 11.73 KJ; calor latente de vaporización: 356.7 KJ.
Niquel: calor latente de fusión: 58 calorías
Plata: calor latente de fusión:109 KJ
Plomo: calor latente de fusión: 6 calorías; calor latente de vaporización: 870 KJ.
Oxígeno: calor latente de fusión: 3.3 calorías
Oro: calor latente de fusión: 67 KJ
Zinc: calor latente de fusión: 28 calorías
Fuente: https://www.ejemplos.co/ejemplos-de-calor-especifico-sensible-y-latente/#ixzz5fTQObXG6
Ejemplos de Temperatura y Calor
A continuación algunos ejemplos de calor y temperatura en diferentes circunstancias:
- La emisión de calor que produce un foco.
- El proceso de calentamiento de un líquido, por el que la parte caliente se mueve hacia arriba y la fría hacia abajo.
- La separación de las moléculas contenidas a una unidad de masa, y entonces el cambio de la fase líquida a la vapor cuando superó el calor de vaporización.
- Las aguas de la superficie del mar, que reciben la radiación del sol.
- Tocar una cuchara que estuvo en un vaso de leche muy caliente, y que consecuentemente también estará caliente.
- El calor que recibe una persona que está cocinando, pese a que no esté efectivamente en el lugar donde se produce el calor
- El doctor, que cuando controla un paciente le toma la temperatura.
- La fundición de una unidad de masa de una sustancia sólida, cuando el cuerpo atravesó el calor de fusión.
- El ejercicio físico, que permite quemar calorías.
- Calor que expele un motor en marcha.
- El agua cuando hierve, porque superó los 100°C.
- En los sólidos con una varilla, el calor se propaga a la varilla.
- Una estufa.
- El punto de curado de materiales refractarios, los 500°C
- El proceso de calentamiento en una sartén, donde el flujo de calor se propaga hacia el mango.
- El punto de deshidratado de partes metálicas, los 250°C.
- El proceso de producción de hielo, llamada solidificación del agua, donde la temperatura se vuelve menor a los 0°C
- La energía calorífica en el vacío, que se propaga por radiación.
- La sustancia refrigerante de la heladera.
- La luz que nos llega del sol, que transporta energía por medio de la radiación.
https://texfire.net/blog/wp-content/uploads/2016/11/post_convectiu.png
Se muestra las distintas formas en las que se libera y recibe la energía calorífica.
Qué es el cero absoluto

Se denomina cero absoluto a la temperatura más baja posible que puede existir. Es también el punto de inicio para la escala Kelvin y para la escala de Rankine. Esta temperatura es de -273.15°C (grados Celsius o centígrados), 0° K (grados Kelvin), o bien 0° R (grados Fahrenheit).
La ciencia afirma, de modo hipotético, que esta es la temperatura más pequeña alcanzable por un cuerpo o molécula. Se cree que en este punto no existe ninguna vibración atómica.
De hecho a −273,15 °C, todos los elementos o sustancias que conocemos se presentarían en estado sólido y sus moléculas ni vibrarían ni se moverían.
Quién descubrió el cero absoluto
 William Thomson (barón Kelvin) fue un matemático y físico británico que intuyó la existencia del cero absoluto.
William Thomson (barón Kelvin) fue un matemático y físico británico que intuyó la existencia del cero absoluto.Se apoyó en el hecho de que cuando un gas se enfría, el volumen del mismo disminuye proporcionalmente a su temperatura. Esto significa que por cada grado de temperatura que disminuye el gas, disminuye también su volumen un tanto por ciento concreto.
Observando este comportamiento, Kelvin calculó que a una temperatura de -273.15°C el volumen del gas sería cero. Algo que es posible que en la práctica no suceda, pero no obstante, te va a sorprender lo que sucede al aproximarse a esta temperatura. Nada parecido al congelador de tu casa.
Qué sucede en el cero absoluto
Teóricamente, si un elemento alcanzase el cero absoluto, sus partículas subatómicas no tendrían energía, ya que los protones y electrones se unirían pasando a formar una especie de “masa cuántica”.
A esta temperatura tan extremadamente baja, el nivel de energía de una sustancia sería el más bajo posible. Esto es debido, según la mecánica clásica, sus partículas carecerían de movimiento alguno. Pero según la mecánica cuántica, esto no sería del todo cierto, ya que el cero absoluto tiene que disponer de un ínfima energía residual, denominada energía de punto cero. Esto es así ya que debe poder cumplirse el principio de indeterminación de Heisenberg
A esta temperatura tan extremadamente baja, el nivel de energía de una sustancia sería el más bajo posible. Esto es debido, según la mecánica clásica, sus partículas carecerían de movimiento alguno. Pero según la mecánica cuántica, esto no sería del todo cierto, ya que el cero absoluto tiene que disponer de un ínfima energía residual, denominada energía de punto cero. Esto es así ya que debe poder cumplirse el principio de indeterminación de Heisenberg
 Al aproximarse al cero absoluto, se producen ciertos fenómenos sorprendentes en la materia como la superfluidez (el helio se transforma en un líquido casi sin viscosidad) y la superconductividad(mayor que la del cobre o el oro).
Al aproximarse al cero absoluto, se producen ciertos fenómenos sorprendentes en la materia como la superfluidez (el helio se transforma en un líquido casi sin viscosidad) y la superconductividad(mayor que la del cobre o el oro).
A una temperatura cercana al cero absoluto, las partículas subatómicas de los elementos poco a poco van perdiendo su energía. Se superponen creando de este modo una especie de superátomo, conocido científicamente como condensado Bose-Einstein.
El físico indio Satyendranath Bose y Albert Einstein presagiaron en 1924 la existencia de un hecho llamado condensado de Bose-Einstein. Según estos científicos, en el cero absoluto los bosones se concentran en un estado cuántico único de energía. Esta teoría se pudo demostrar finalmente en el año 1995.
Aplicaciones reales del cero absoluto
A temperaturas cercanas al cero absoluto se pueden crear superfluidos, o incluso algunas moléculas que no se encuentran en temperaturas más elevadas.
La disminución de la temperatura hasta este punto es muy útil para los científicos que pueden estudiar, de este modo, las características y comportamientos cambiantes de ciertos materiales.
La disminución de la temperatura hasta este punto es muy útil para los científicos que pueden estudiar, de este modo, las características y comportamientos cambiantes de ciertos materiales.

Podemos hallar una aplicación práctica en el conocido acelerador de partículasLHC del CERN. En el LHC (Gran Colisionador de Hadrones) se trabaja en ocasiones a temperaturas de -271,25 °C.
Algunos de los experimentos que se realizan en esta instalación europea precisan la criogenización de algunos circuitos para que sean superconductores. Esto se consigue con la combinación de compresores de helio que envían nitrógeno líquido a los circuitos a −193,15 °C.
Otro caso práctico sería el de los superconductores que se utilizan actualmente en los sistemas empleados de levitación magnética (como por ejemplo en algunos trenes bala experimentales).
Cómo conseguir el cero absoluto
Actualmente, el cero absoluto es todavía una temperatura teórica. Hasta la fecha no se ha conseguido alcanzar tan ínfima temperatura. Pero se ha estado muy cerca, ya que el Instituto Tecnológico de Massachusetts (MIT) consiguió crear temperaturas de -273,14°C en el año 2003. Se consiguió enfriando un gas dentro de un campo magnético.
Pese a que en los laboratorios la ciencia puede aproximarse mucho a esta temperatura, la tercera ley de la termodinámica sugiere que el cero absoluto es algo imposible de conseguir.
Puedes obtener muchas más información al respecto en el siguiente vídeo:
El cero absoluto en el universo
 Dentro del sistema solar se tiene constancia de zonas con temperaturas cercanas a los -240°C. Se registran en lugares que se hallan en sombra constante, como por ejemplo, cráteres del polo sur de la Luna.
Dentro del sistema solar se tiene constancia de zonas con temperaturas cercanas a los -240°C. Se registran en lugares que se hallan en sombra constante, como por ejemplo, cráteres del polo sur de la Luna.
En el espacio profundo, la temperatura más cercana al cero absoluto de la que se tiene constancia es -272°C. Registrada por un satélite artificial, se detectó en la Nebulosa del Boomerang, en la constelación de Centaurus, a unos 5.000 años luz de distancia.
Por otro lado, las nubes de gas en el universo suelen tener una temperatura de aproximadamente -269°C. Este frío es producido por la radiación cósmica de microondas.
https://www.curiosfera.com/que-es-el-cero-absoluto/. (2014). QUE ES EL CERO ABSOLUTO. 14/02/2019, de CURIOSFERA Sitio web: https://www.curiosfera.com/que-es-el-cero-absoluto/
 HASTA HACE UNAS DÉCADAS SE SUPONÍA QUE ESTO ERA TAN SOLO UNA TEORÍA O IDEA, SIN EMBARGO AHORA SABEMOS QUE EXISTE Y QUE DAN RECIPROCO PUEDE LLEGAR A SER EN TANTO NUESTRA VISIONA DE NUESTRO MUNDO Y EL COSMOS
HASTA HACE UNAS DÉCADAS SE SUPONÍA QUE ESTO ERA TAN SOLO UNA TEORÍA O IDEA, SIN EMBARGO AHORA SABEMOS QUE EXISTE Y QUE DAN RECIPROCO PUEDE LLEGAR A SER EN TANTO NUESTRA VISIONA DE NUESTRO MUNDO Y EL COSMOS
https://www.definicionabc.com/wp-content/uploads/ciencia/Cero-Absoluto.jpg

El calor especifico de un objeto puede variar de acuerdo a los materiales que los compone e incluso otros factores, ejemplo, una cacerola de acero y agua hirviendo dentro de si.
teniendo en cuenta esto, hay diversos materiales los cuales se pueden llegar a calentar mas rápido o mas lento, y con cierta necesidad de una temperatura, por ejemplo.
entre el cobre y el aluminio, es mas probable que es cobre se caliente mas que el aluminio mismo, y respecto a ello y la manera en que lo percibimos surge la temperatura como medida para aquel calor que sentimos.
























No hay comentarios:
Publicar un comentario